Una reacción química es un proceso en el que se forman nuevas sustancias. Los átomos con los que comienza se reagrupan en nuevas sustancias que tienen diferentes propiedades. Es importante recordar que la cantidad de átomos antes y después de una reacción química siempre permanece igual.
Para comprender mejor las reacciones químicas…
¡ESTUDIÉMOSLO PASO A PASO!
Cuando las sustancias experimentan reacciones químicas, sus propiedades cambian.

Toda materia tiene propiedades, y esas propiedades se pueden observar y registrar. Las propiedades de la materia también se pueden probar para ayudar a determinar qué es la sustancia. Ejemplos de estas propiedades son el magnetismo, la inflamabilidad, la densidad y el olor. Existen muchas otras propiedades de la materia y, al examinar las propiedades de una sustancia, puede ayudarnos a predecir cómo puede interactuar con otras sustancias.
El número total de átomos no cambia en una reacción química.
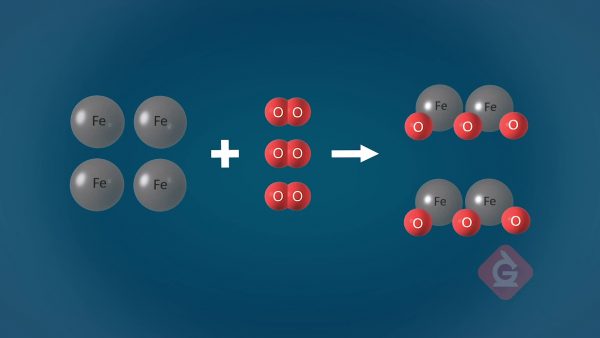
Esto se conoce comúnmente como la Ley de Conservación de la Materia. Debido a que la materia no se puede crear ni destruir, los átomos solo pueden reorganizarse en una reacción química. Por esta razón, la masa final después de que haya tenido lugar una reacción será idéntica a la masa inicial antes de que tuviera lugar la reacción, incluso si se formaron nuevas sustancias. Los átomos se combinan para formar moléculas, y esas moléculas interactúan con otras de manera diferente según sus propiedades. Cuando las moléculas interactúan entre sí, se reorganizan para formar nuevas sustancias que tienen propiedades diferentes a las de antes.
En los cambios físicos no se forman nuevas sustancias.

Los cambios físicos dan como resultado cambios de estado o cambios de fase. No dan como resultado la formación de nuevas sustancias. La fusión y la congelación son ejemplos de cambios de fase. El aumento y la disminución de la temperatura de una sustancia hace que las moléculas se acerquen, formando un sólido, o se alejen más, formando un líquido o un gas. Muchos estudiantes piensan que disolverse es un cambio físico (o de fase). Sin embargo, la disolución es el resultado de una reacción química en la que se descompone una sustancia, en lugar de dos sustancias que se combinan para formar una nueva sustancia. Las reacciones químicas también pueden resultar en nuevas sustancias cuando una sustancia se descompone después de agregar mucha energía. ¡Un ejemplo de esto es TNT (trinitrotolueno)!
Los reactivos se combinan o reorganizan para formar productos.

Debido a que la materia no se puede crear ni destruir, cuando los átomos se reorganizan en presencia de un catalizador, se forman nuevas sustancias llamadas productos. Estos productos suelen tener propiedades diferentes a las de los reactivos, aunque se ha conservado la cantidad total de masa en el sistema. Por ejemplo, encender una parrilla de gas requiere la combustión de propano. La reacción química se ve así:
C3H8 (propano) + 5O2 3CO2 + 4H2O
Hay 10 átomos de oxígeno en ambos lados de la ecuación, pero los átomos de oxígeno se han reorganizado combinándose con hidrógeno y carbono para crear dióxido de carbono y agua. El mismo número de átomos está presente antes y después de la reacción química, pero se han formado nuevas sustancias en productos.
Muchas carreras utilizan reacciones químicas para resolver problemas.

Los ingenieros químicos y los científicos de materiales estudian las reacciones químicas para avanzar en la exploración espacial, fabricar medicamentos y crear nuevos productos que resuelvan problemas únicos. Los químicos profesionales trabajan junto con otros científicos para combinar sustancias en función de sus propiedades. Las propiedades de cada sustancia determinan cómo interactúa con otras sustancias para formar nuevas sustancias químicas. ¡Los científicos estudian estas propiedades y las interacciones entre sustancias para resolver problemas y hacer avanzar el mundo de la ciencia!























































































































 Select a Google Form
Select a Google Form







 GENERATION GENIUS
GENERATION GENIUS




